
- מְחַבֵּר Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- שונה לאחרונה 2025-01-22 16:59.
ה מסה אטומית ממוצעת עבור א אֵלֵמֶנט הוא מְחוֹשָׁב על ידי סיכום ה המונים של ה אלמנטים איזוטופים, כל אחד מוכפל בשפע הטבעי שלו על פני כדור הארץ. כאשר עושים כל מסה חישובים הכוללים יסודות או תרכובות, השתמש תמיד מסה אטומית ממוצעת , שניתן למצוא ב- טבלה מחזורית.
לפי זה, כיצד נקבעות המסות האטומיות בטבלה המחזורית?
ביחד, מספר הפרוטונים ומספר הנייטרונים לקבוע an מסת האלמנט מספר. מאז א אלמנטים לאיזוטופים יש מעט שונה מסה מספרים, ה מסה אטומית הוא מְחוֹשָׁב על ידי השגת הממוצע של ה מסה מספרים עבור האיזוטופים שלו.
יתר על כן, איזה יסוד משמש כבסיס למערכת המסה האטומית? דלטון בחר במימן להיות הסטנדרט עבור הטבלה שלו מסות אטומיות ונתן לאטום המימן א מסה של 1. כמובן, הוא יכול היה לבחור כל אחר אֵלֵמֶנט וכל ערך אחר עבורו מסה אטומית . אבל מימן היה הקל מביניהם אלמנטים ו-1 הוא המספר הקל ביותר לביצוע השוואות.
באופן דומה, נשאל, לאיזה איזוטופ יש מסה אטומית הקרובה ביותר למסה האטומית הממוצעת הרשומה בטבלה המחזורית?
כל ה המונים של היסודות נקבעים ביחס ל-12C. מאז הרבה אלמנטים יש מספר של איזוטופים , משתמשים כימאים מסה אטומית ממוצעת . על טבלה מחזורית ה מסה של פחמן מדווח כ-12.011 אמו.
האם המסה האטומית נמצאת בטבלה המחזורית?
הסטנדרט אָטוֹמִי המשקל הוא הממוצע מסה של אֵלֵמֶנט ב מסה אטומית יחידות ("אמו"). אם כי אינדיבידואלי אטומים תמיד יש מספר שלם מספר שֶׁל מסה אטומית יחידות, ה מסה אטומית בטבלה המחזורית מצוין כעשרוני מספר כי זה ממוצע של האיזוטופים השונים של an אֵלֵמֶנט.
מוּמלָץ:
מהי המסה האטומית הממוצעת של אטום?

המסה האטומית הממוצעת של יסוד היא סכום המסות של האיזוטופים שלו, כל אחד מוכפל בשפע הטבעי שלו (העשרוני הקשור לאחוז האטומים של אותו יסוד שהם של איזוטופ נתון). מסה אטומית ממוצעת = f1M1 + f2M2 +
איך מחשבים את המסה האטומית הממוצעת של סטרונציום?

אז, אנו מחשבים אותו על ידי לקיחת המסה המשוקללת של כל אחד מהאיזוטופים וחיבורם יחד. אז, עבור המסה הראשונה, נכפיל 0.50% מ-84 (אמו - יחידות מסה אטומית) = 0.042 אמו, ונוסיף את זה ל-9.9% מ-86 אמו = 8.51 אמו, וכן הלאה
איך מחשבים את המסה האטומית של בורון?
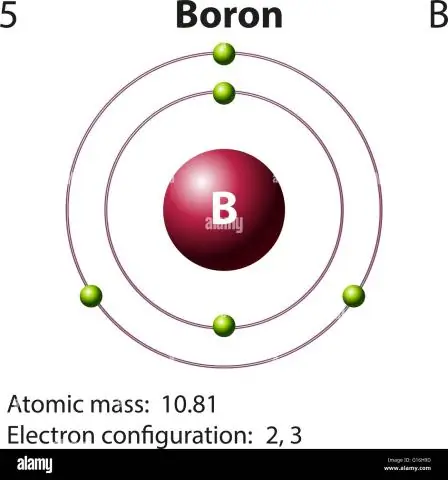
עבור בורון, משוואה זו תיראה כך: 5 פרוטונים + 5 נויטרונים = 10 יחידות מסה אטומית (AMU) או, עבור איזוטופ הבור הנפוץ יותר (כ-5 פרוטונים + 6 נויטרונים = 11 AMU)
איפה המסה בטבלה המחזורית?

בטבלה המחזורית, מספר המסה ממוקם בדרך כלל מתחת לסמל היסוד. מספר המסה הרשום הוא המסה הממוצעת של כל האיזוטופים של היסוד. לכל איזוטופ יש אחוז שפע מסוים המצוי בטבע, ואלה מתווספים וממוצעים כדי לקבל את מספר המסה הממוצע
לאיזה יסוד יש את המסה האטומית הגדולה ביותר?

Ununoctium הוא היסוד הכבד ביותר, אבל הוא מעשה ידי אדם. היסוד הכבד ביותר המתרחש באופן טבעי הוא אורניום (מספר אטומי 92, משקל אטומי 238.0289)
